Kapitel 1.1 - Atomarer Aufbau
Bohrsches Atommodell (Schalenmodell)
Jedes Atom besitzt einen Kern und eine Hülle. Im Kern befinden sich die positiv geladenen Protonen sowie die elektrisch neutralen Neutronen. In der Hülle bewege sich die negativen geladenen Elektronen. Jedes Proton und Elektron trägt eine Elementarladung. Proton Neutron Elektron
Masse
in 10-24g 1,66 1,66 0,00091
Durchmesser
in cm 10-15 – 10-14 10-15 – 10-14 10-13 – 10-12
Ladung
in 10-19 As +1,6 0 -1,6
Die räumliche Verteilung der Elektronen um den Kern wird durch vier Quantenzahlen (Orbitalmodell) ausgedrückt.
Das Orbital oder Wolkenmodel
Es beschreibt die Aufenthaltswahrscheinlichkeit der Elektronen. Dabei können sich Elektronen nur in den rechtwinklig zueinander stehende Achsenrichtungen bewegen.Hauptquantenzahl (n)
Die Hauptquantenzahl entspricht den Schalen im Bohrschen Atommodell 1, 2, 3, …. Maximal können sich ns = 2 n2 Elektronen auf der entsprechenden Schale aufhalten. Neben der numerischen Beschreibung der Hauptschalen kann diese auch mit Buchstaben erfolgen beginnend mit K, L, M, N, … Maximal aufgefüllte Schalen stellen einen energetisch stabilen Zustand dar.Nebenquantenzahl (l)
Die Nebenquantenzahl oder auch Drehimpulsquantenzahl kennzeichnet die Form des Orbitals in einem Atom. Die Nebenquantenzahl kann werte von l=0 – (n-1) annehmen die auch mit römischen Kleinbuchstaben gekennzeichnet sind: s, p, d, f, g, … Die s Schale beschreibt eine Kugel, die p Schale eine einfache 8 die d Schale 2 kombinierte 8ten usw.Magnetquantenzahl (m)
Die Magnetquantenzahl kann Werte von m= (-l) – l annehmen und beschreibt die räumliche Orientierung der Orbitale. Zum Beispiel die 3 Orbitale einer Unterschale p (l=1) sind in 3 Richtungen senkrecht zueinander in einem Rechtwinkligen Dreieck angeordnet px, py, pz entsprechend den drei verschiedenen Werten von m=-1, 0, 1.Spinquantenzahl (s)
Die Spinquantenzahl bestimmt die eigentliche Drehrichtung des Elektrons um sich selbst. S kann nur 2 Werte annehmen ±½.Hundsche Regel
Beim Auffüllen der Elektronenschale werden zuerst die Elektronen mit parallelem Spin aufgefüllt, dann die mit Antiparallelem Spin. Bzw. es werden erst die Niveaus mit niedriger Energie Aufgefüllt.Pauliprinzip
Innerhalb eines Atoms können niemals 2 Elektronen vorkommen, die in allen vier Quantenzahlen übereinstimmen.Reihenfolge der Energieniveaus
Ab der 3. Periode überschneiden sich die Energieniveaus einer Unterschale mindestens mit den Energieniveaus der darüber liegenden Schale. Dies hat zur Folge, dass eine neue Schale besetzt wird, Während die darunterliegende noch nicht voll besetzt ist. Elemente mit dieser Elektronenkonfiguration nennt man Übergangselemente.Kapitel 1.2 Bindungsarten
Atombindung – Kovalente Bindung – Elektronenpaarbindung
Hierbei handelt es sich um eine Verbindung von Nichtmetallen. Ihre Struktur wird durch bindende Elektronenpaare zusammengehalten. Ziel der Verbindung ist es Edelgaskonfiguration zu erreichen. Bei ungleichen Partnern könne sich die Ladungen verschieben. Auf diese Weise entstehen Dipole. Atome mit solch einer Bindung haben eine hohe Härte, hohe Schmelz- und Siedepunkte und eine Unlöslichkeit der Kristalle.Ionenbindung
Die Ionenbindung entsteht durch die Anziehungskräfte von positiv und negativ geladenen Ionen. Hierbei handelt es sich um eine Verbindung von Metallen und Nichtmetallen. Das Metall gibt sein Elektron ab und wird zu einem Kation, das Nichtmetall nimmt das Elektron auf wird zu einem Anion. Durch diese unterschiedliche Ladung bleiben die Atome durch die Coulombkraft bei einander. Atome mit solch einer Bindung haben eine hohe Gitterenergie und damit hohe Schmelz- und Siedepunkte.Metallische Bindung
Sie beschreibt die Bindung zwischen 2 Metallen. Dabei werden die Valenzelektronen abgegeben. Wenn viele Valenzelektronen abgegeben werden könne spricht man auch von einer Elektronen Delokation . Dabei befinden sich die Elektronen in einer Elektronenwolke.Solche Verbindungen haben eine gute elektrische Leitfähigkeit, sind gute Wärmeleiter, besitzen einen metallischen Glanz und sind undurchsichtig.
Van der Waals Bindung
Sie ist die schwächste Bindung und wirkt zwischen Molekühlen. Es gibt zwei Arten. Zum einen die intermolekulare Dipol Bindung die als Ursache permanent elektrische Dipole vorweist und induzierte Dipol Wechselwirkungen, auch Dispersionsbindung, die auf Grund von momentanen Ladungssymmetrien entstehen. Diese Bindung wirk sich zumeist auf die physikalischen Eigenschaften aus.Kapitel 1.3 Kristallstrukturen
Kristalline Verbände bilden atomare, ionische oder molekulare Verbände die sich gleichmäßig im Raum verteilen. Kristalline Stoffe haben eine feste Schmelztemperatur TS bei der Sie flüssig werden. Mit steigender Temperatur nimmt das Volumen zu, welches sprungartig bei TS ansteigt.Amorphe Verbände sind Stoffe die keine geordnete Struktur aufweisen. Amorph heißt gestaltlos. Wie die kristallinen Verbände besitzen sie eine Schmelztemperatur und vergrößern mit steigender Temperatur ihr Volumen mehr als kristalline Verbände. Zusätzlich besitzen sei eine Glasübergangstemperatur TG unterhalb von TS wo sie beginnen zu fließen.
Bei beiden Verbänden singt mit steigender Temperatur das G-Modul wobei Amorphe Verbände einen zusätzlichen Sprung bei TG aufweisen.
Elementarzellen und kubische Gitterstrukturen
Eine Elementarzelle ist die kleinste sich wiederholende Volumeneinheit im Gitteraufbau. Sie wird durch die Achsen und Winkel beschrieben.| Kubisch | a=b=c | α=β=γ=90° |
| Tetragonal | a=b≠c | α=β=γ=90° |
| Rhombisch | a≠b≠c | α=β=γ=90° |
| Hexagonal | a=b≠c | α=β=90°, γ=120° |
| Trigonal | a=b=c | α=β=γ≠90° |
| Monoklin | a≠b≠c | α=β=90°, γ≠90° |
| Triklin | a≠b≠c | α≠β≠γ≠90° |
Gitterebene Millersche Indizes (hkl)
Sie dienen der eindeutigen Beschreibung von Richtungen und Ebenen. Besondere Bedeutung findet diese in der Kristallographi um Kristallflächen eindeutig zu beschreiben.Vorgehensweise:
1. Lege einen Ursprung im Kristallgitter fest
2. Bestimme die Schnittpunkte mit den Koordinatenachsen
3. Bilde den Kehrwert
4. kleinsten Hauptnenner bilden. Die Zählerzahlen entsprechen den Millerschen Indizes
Jede so gebildete Ebene wird in runde Klammern geschrieben (hkl). Je nach Betrachtung können immer die selben Ebenen gemeint sein. Man kann diese dann zusammenfassend in geschweifte Klammern Schreiben {hkl}. Richtungen senkrecht auf einer Ebene stehen werden in eckige Klammern geschrieben [hkl] Welche wie bei den Ebenen zusammengefasst werden können zu spitzen Klammern <hkl>. Auf diese Weise lässt sich jede Richtung und Ebene eineindeutig beschreiben.
Dichteste Kugelpackung
Sie ist das Verhältnis von Volumen einer Elementarzelle zum Volumen der darin vorkommenden Atome.Diamantstrukturen
Die Atome in einer Elementarzelle sind tetraedisch angeordnet. Wird eine solche Zelle planar angegeben. So schreibt man die Höhenlage eines Atoms als Bruch zwischen 0 und 1.Gitterfehler
Nulldimensionale Gitterfehler - PunktfehlerHierbei handelt sich um drei Arten von Fehler. Die Leerstellen, Zwischengitteratome und Fremdatomeinlagerung. Leerstellen und Zwischengitteratome hängt von der Temperatur ab und kann wie folgt berechnet werden:
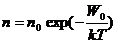
mit n0 Anzahl der Atome pro Volumeneinheit, W0 Energie zur Bildung eines Gitterfehlers und k die Bolzmannkonstante K=1,38 10-23 J/K.
Eindimensionale Fehler - Linienfehler
Dies sind Linienförmige Fehler, Versetzungen, wie Stufen- oder Schraubenversetzungen. Ohne Versetzungen ist keine plastische Verformung möglich. Jede plastische Verformung erzeugt neue Versetzungen.
Zweidimensionale Fehler - Flächenfehler
Dies sind Grenzflächenfehler, Oberflächenfehler, Korngrenzen und Phasengrenzen
Korngrenzen sind Gitter mit gleicher Art von Atomen aber unterschiedlicher Raumorientierung die aufeinander treffen.
Phasengrenzen sind Gitter mit unterschiedlichen Atomarten und unterschiedlicher Raumorientierung, die aufeinander treffen, Wobei die Gitter völlig unlöslich im festen sind, sich also die verschiedenen Atome nicht mischen
Kleinwinkelkorngrenzen stehen in einem Winkel von unter 15° zueinander.
Dreidimensionale Fehler – raumförmige Fehler
Hierbei handelt es sich um Cluster, Ausscheidungen und Poren.
In Clustern kommt es in bestimmten Gittergebieten (Zonen) zur Anhäufung von Fremdatomen, ohne dass sich eine eigene Phase bildet.
Poren sind Ansammlungen von Leerstellen
Ausscheidungen sind eingelagerte oder oberflächliche Fremdatome.
Anisotropie und Texturen
Es gibt 3 Fälle von Isotropie (Unabhängigkeit der Eigenschaften von einer Richtung): Anisotropie ist das Gegenteil der IsotropieQuasiisotrop ist Materie wenn sie Eigentlich nicht Isotrop ist jedoch makroskopisch Isotrop auftritt
Der wichtigste Parameter zur Beschreibung der Anisotropie polykristalliner Werkstoffe ist die Textur. Im Falle einer regellosen Textur, bei der alle Orientierungen. gleich häufig vorhanden sind, ist das Verhalten des polykristallinen Materials isotrop
Kapitel 1.4 Phasen und Zustandsdiagramme
Flüssig, fest, gasförmig – Keimbildung
Je nach Temperatur haben Werkstoffe einen anderen Aggregatszustand. Wird Energie in Form von Wärme zugeführt oder entnommen ändert sich dieser.Hat ein Werkstoff viel Energie, also eine hohe Temperatur, liegt er in flüssiger Form vor, so entsteht beim abkühlen die Keimbildung. Je schneller der Werkstoff abgekühlt wird umso mehr Keime entstehen. An den Keimen werden Bindungen wiederaufgebaut und Atome verbinden sich. So bildet jeder Keim ein Gitter, dass gegenüber seinem Nachbarkeim eine andere Orientierung hat. So entstehen Korngrenzen.
Schmelzen und Erstarren
Der Energieerhaltungssatz besagt, dass die Wärmemenge für das Schmelzen eines Stoffes die gleiche ist wie beim erstarren mit unterschiedlichen Vorzeichen. Der Übergang von Fest in flüssige Form erfolgt langsam, so wie die Bindungsenergien zwischen den Atomen überwunden werden. Diese Temperatur heißt Schmelztemperatur TS.Binare Legierungen
Vollkommene Unlöslichkeit zweier Metalle im flüssigen und festen ZustandIst ein Stoff unlöslich, so bilden sich Gitterbereiche mit nur einer Art von Atomen. Die Stoffe sind koexistent. Somit haben beide Stoffe auch eine unterschiedliche Schmelztemperatur und während ein Stoff noch flüssig ist, kann der andere noch als Schmelze vorliegen.
Vollkommen löslich im festen und flüssigen Zustand
Lösliche Stoffe mischen sich in einer Schmelze und bilden beim Abkühlen eine gemeinsame Gitterstruktur. Es entsteht ein Mischkristall. Die Mischkristallbildung solcher Stoffe werden mittels Liquidius- Soliduslinen Linien in einem Diagramm dargestellt. Mittels Hebel-Gesetzt kann aus diesem Diagramm der Mengenanteil an Schmelze und Kristall berechnet werden.
Vollkommene flüssige Löslichkeit und vollkommene feste Unlöslichkeit
Diese Stoffe werden Eutektikum genannt. Der eutektische Punkt beschreibt das Mischungsverhältnis und die Temperatur bei der beide Stoffe gleichzeitig erstarren. Es entsteht ein α + β Mischkristall mit Lamellenstruktur. Mit Änderung der Konzentration von α + β werden zunehmend mehr Regionen mit α oder β Kristallen gebildet.
Kapitel 1.5 Leitungsmechanismen
Definition
Elektrische Leitfähigkeit im flüssigen. Hierbei handelt es sich um Ionenleitung. Ein im Wasser disoziierter Stoff z.B. NaCl, Hier wandern positiv geladene Atome zur Anode (Na+) und negativ geladene zur Kathode (Cl-). Da sich hier ganze Atome bewegen spricht man auch von Stofftransport.Elektrische Leitfähigkeit im festen. Dies ist ein Leitungsmechanismus ohne Stofftransport, da sich nicht die Atome sondern nur die Elektronen bewegen.
Leiter – Halbleiter – Isolatoren
Leiter weisen eine Leitfähigkeit von κ > 103 S/cm auf. Halbleiter von 103 < κ < 10-4 S/cm und Isolatoren liegen bei κ < 10-4 S/cm. Die Leitfähigkeit lässt sich berechnen:Κ = e0 n μ (n0=Elementarladung 1,602*10-19 C; n = Anzahl der frei beweglichen Elektronen; μ = Beweglichkeit der Elektronen) Bei Metallen ist n konstant und μ variabel. Die Konzentration von Leitungselektronen in Leitermetallen liegt bei 1022 /cm3.
Die Einteilung kann auch über den spezifischen Widerstand erfolgen. Es gilt U=I*R=I*ρ*l/A und somit κ = 1/ ρ
Beweglichkeit der Elektronen
Die mittlere Driftgeschwindigkeit vd ist eine der allgemeinen Teilchenbewegung überlagerte, in eine bestimmte Richtung weisenden Geschwindigkeit.Strom durch einen Leiterabschnitt I=Q/t = n*e0*A*l/t; vd=l/t=μ*E=μ*U/l=I/(n*e0*A); μ = vd/ E = vd * l / U = κ / ( n * e0).
Leitungsträgerkonzentration
Für Metalle, Halbmetalle und Halbleiter kann die Ladungsträgerkonzentration methematisch erfasst werden zu:n = NA* ρ / mA = NA/ Vm (NA Avogadro 6*1023; mAAtomgewicht ρ = mA / Vm = Dichte; Vmmolares Volumen = mA / ρ)
Bändermodell
In einem einzelnen Atom existieren die Elektronen auf Energieniveaus mit definierten Energiebeträgen. In Festkörpern lagern die Atome so dicht aneinander, dass die Wechselwirkungen zwischen ihnen unbedingt berücksichtigt werden müssen, da es dadurch zu einer gegenseitigen Beeinflussung kommt.Nähern sich z.B. 2 Atome so spaltet sich jedes Energieniveau zweifach auf (Bei 6 Atomen sechsfach). Die so entstandenen Energieniveaus liegen durch ihre geringe Energiedifferenz so dicht beisammen, dass sie praktisch ein Band bilden. Je weiter sich ein Niveau vom Atomkern weg befindet desto stärker ist die Spaltung. Dadurch entstehen Bänder die allen Atomen in Gitter gehören. Dieses Leitungsband Liegt oberhalb der Energie des Potentionalrichter W*R. Ist die Energie < W*R so sind die Elektronen am jeweiligen Kern lokalisiert. Zwischen den Bändern besteht kein gültiges Energieniveau. Dies ist eine verbotene Zone. Das oberste Band für das gilt E < W*R heißt Valenzband (VB), das Band für E > W*R heißt Leitungsband (LB). Eine Elektronenleitung ist nur in halb besetzten Bändern möglich. In vollbesetzten Bändern gibt es keinen Energiezustand der besetzbar ist.
Metalle und Isolatoren
Metallischer Leiter der ersten Art. Hier sind Grund- (VB) und Leitungsband (LB) beteiligt. Beide Bänder sind nicht voll besetzt. Al, Cu, Ag,…Metallische Leiter der zweiten Art. Hier ist das letzte Band (VB) voll besetzt und lappt in das Leitungsband hinein. Somit verschwindet die Barriere zwischen VB und LB und Elektronen können fließen. Erdalkalimetalle.
Bei Isolatoren ist das VB voll besetzt und das LB ist leer. Die verbotene Zone ist breiter als 3eV. Somit können nur bei Zufuhr entsprechend hoher Energie oder durch hohe Temperaturen die Elektronen vom VB ins LB gelangen. (z.B. Durchschlag)
Halbleiter sind im Grunde Isolatoren wobei die verbotene Zone weniger als 3eV beträgt. Somit können Leitungselektronen schon bei geringer Anregungsenergie entstehen. Es liegt die Eigenhalbleitung oder intrinsiche Leitung vor. Die Generation ist der Übergang der Elektronen vom VB in das LB. Hierbei entstehen im LB Elektronen (n) und im VB Löscher (p). Beim fließen der Elektronen kommt es zu Wechselwirkungen mit dem Gitter und zu einem Energieverlust, so dass Elektronen wieder ins VB fallen. Dieser Prozess heißt Rekombination. Die Konzentration der Ladungsträger errechnet sich zu ni2 = n*p, wobei des thermodynamische Gleichgewicht besagt; ni = n = p. Hieraus kann die Leitfähigkeit errechnet werden zu: κ= e0*n* μn+e0*p* μp=e0*ni*( μn+ μp).
Dotierung
Hierbei werden in das Halbleitergitter , Grundstoff hierfür ist Silizium, Fremdatome eingelagert um die Leitfähigkeit zu erhöhen.n- Halbleiter
Es werden Elemente aus der 5. Hauptgruppe in das Si-Gitter eingelagert. Diese Gruppe heißt Donatoren. Mit 4 Elektronen wird eine Bindung mit dem Silizium eingegangen, das 5. Elektron bildet ein neues Energieniveau im verbotenen Bereich des Bändermodells. Mit einer geringen Energie Ed kann das Elektron in das Leitungsband angehoben werden. Bei der n-Dotierung gibt es mehr Majoritätsladungsträger (freie Elektronen) wie Minoritätsladungsträger (Löcher). Es gilt n = p + pD (pD Konzentration Donatoratomen) somit ist n >> p und es gilt κ ≈ e0*n*μ.p- Halbleiter
Hier werden Elemente der 3. Hauptgruppe, Akzeptoren, eingelagert. Dotierung mit 3-wertigen Atomen führt zu einer ungesättigten Bindung. Das fehlende Elektron kann mit geringem Energieaufwand Ea aus einer anderen Bindung gerissen werden. Es entsteht wiederum ein neues Band in der verbotenen Zone, jetzt jedoch oberhalb des VB. Jetzt sind die Elektronen die Minoritätsladungsträger und die Löscher die Majoritätsladungsträger. Somit gilt p >> n und κ ≈ e0*p*μ.Temperatureinfluss
Die Konzentration der frei beweglichen Elektronen ist temperaturabhängig und kann wie folgt berechnet werden: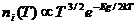
Wenn T ↑ →n(T) ↑ oder →μ ↓ oder → Eg ↑
n-p-Übergänge – Halbleiterdioden
Wenn zwei unterschiedlich dotierte Halbleitermaterialien zusammen gebracht werden, ohne das ein Feld am p-n-Übergang angelegt wird, so kommt es auf Grund er unterschiedlichen Ladungsträgerkonzentration in den beiden Schichten zu einer Diffusion der beweglichen Ladungsträger. (Konzentrationsausgleich). Aus der n-Zone wandern die Elektronen Richtung p-Zone und umgekehrt. Der so resultierende Diffusionsstrom ist vom Diffusionsgefälle abhängig (von der Stärke der Dotierung). Die Rekombination führt zu einem elektrischen Feld der Sperrschicht, dessen Ursache in den, im Gitter fest verankerten, Donatoren und Akzeptoren zu finden ist. Wird ein Feld in Sperrrichtung (Plus am n-Gebiet) angelegt, verstärkt sich diese Wirkung. Nur die noch nicht rekombinierten Minoritätsladungsträger könne sich noch bewegen, es fließt der geringe Sperrschichtstrom. Wird das Feld in Durchlassrichtung angelegt, so wird das Sperrschichtfeld gehemmt. Bei Si ist ab einer Spannung von 0,6 V diese Sperrschicht nicht mehr vorhanden.Regel von Matthiesen
Elektrischer Widerstand setzt sich zusammen aus thermischen Anteil ρth und temperaturunabhängigen Anteil ρS: Der Anteil ρS wird durch die Streuung an der Gitterstruktur und Strukturdefekte erzeugt: ρ = ρth + ρSρ = CαT α ist negativ wenn mit steigender Temperatur die Leitfähigkeit zu nimmt.
Reinheit, Legierungsarten
Allgemein gilt, je höher der Reinheitsgrad umso besser ist die Leitfähigkeit. Dies gilt auch bei Fremdatomeinlagerungen. Bilden die Komponenten einer Legierung eigene Phasen (Völlige Unlöslichkeit, dann hängt der spezifische Widerstand nahezu linear vom Volumenanteil der an der Legierung beteiligten Phasen ab. Besteht die Legierung aus völlig Löslichen Komponenten, ein Mischkristall, so sinkt die Beweglichkeit der Elektronen mit Zunahme der Streuung an Gitterfehlern. Wenn durch solch eine Legierung ein Strom fließt, so fliest ieser über den kompletten Querschnitt des Leiters (wünschenswert). Wohingegen bei teilweiser Löslichkeit (Lamellenstruktur bei Eutektikum) der Strom nur durch die Phasen mit dem geringern Widerstand fließt, Volumenanteilabhängigkeit.Aus der Mattheisenschen Regel folgt das der Temperaturkoeffizient bei Mischkristallen kleiner ist. Und das Produkt aus Koeffizient und spezifischen Widerstand konstant ist.
Elektrische Leitfähigkeit an dünnen Schichten
Unterscheidet man einen Draht zu einer Schichtdicke dS die dünner ist wie die mittlere Zitterbewegung der Elektronen (Leiterbahnen in Chips), so muss die Mattheisensche Regel um einen Widerstandsanteil erweitert werden: ρ = ρth + ρS + ρD. Bei allen Abscheidungen von Schichten auf einem Substrat gibt es Wechselwirkungen. Diese wirken innerhalb einer Grenzfläche zum Substrat und zur Umgebung. Abhängig vom Material muss ab der Unterschreitung einer Schichtdicke ρD beachtet werden: Au < 150 μm Cu < 300 μm.Kapitel 1.6 Mechanische Verformung
Beanspruchungsarten
Dehnung (ε) –
Zugspannung σ=F/A
Scherung –
Schubspannung τ= Gγ
Verdichtung –
Komression ΔV/V
Verdrillung –
Torsion
Durchbiegung –
Biegemoment
Reversible Verformung Formänderung verschwindet
unmittelbar bzw. eine
bestimmte Zeit nach
Beendigung der Krafteinwirkung. Der Körper kehrt in seine
ursprüngliche Gestalt
zurück = Elastische Verformung
Irreversible Verformung: Formänderung
bleibt nach Beendigung der
Krafteinwirkung erhalten =
plastische Verformung
Elastische Verformung
Bei der elastischen Verformung ändern sich die
Anstände und Achsenwinkel. Dabei erhöht sich der Energieinhalt des Gitters
durch die aufgezwungene Spannung. Da jedes System bestrebt ist die niedrigste
Energiestufe einzunehmen, kehren die Gitterbausteine nach der Entlastung wieder
in ihren stabilen Zustand zurück. Bei der elastischen Verformung ändert sich
der Widerstand des Werkstoffes auf Grund der Deformation des Gitters und damit
wegen der Beweglichkeit der Leitungselektronen.
Materialkonstanten
Spannung ist Kraft pro Ausgangsfläche σ=F/A
Dehnung ist die Längenänderung pro Ursprungslänge ε=ΔL/L
Elastizitätsmodul ist Spannung pro Dehnung E= σ/ ε
Schubspannung ist Kraft pro Ausgangsfläche τ=F/A
Abscherung ist die Längenänderung pro Ursprungslänge γ=ΔL/L
Gleitmodul ist Schubspannung pro Abscherung G= τ/ γ
Poisson-Zahl
Die Possionzahl
(Querkontraktionszahl) stellt die Längendehnung zur Querdehung ins Verhältnis
ν= εd/ ε. Aus V=l*d*d = (l+Δl)(d-Δd)2
Ausmultiplizieren, Produkte von Δ vernachlässigen folgt direkt ν <
½.
Alle 3 Größen hängen über E=2(1+ ν)G zusammen. Bei Metallen gilt E~ 10-350 GN/m2 mit
ν=0,3.
Spannung und
Dehnung
Die Streckgrenze RP
trennt elastische von plastischer Verformung. Technisch entspricht dies einer
Längenänderung eines Stabes um 0,2 %.
Die Maximale
Zugfestigkeit ist die Festigkeitsgröße Rm. Sie beschreibt das
Maximum in der Spannung Dehnungskurve ohne den veränderten Querschnitt zu
beachten.
Die wahre Spannung
kf ist die Kraft pro wahre Fläche.
Plastische Verformung
Die
Gleitebene in einem Metall bildet diejenige Ebene mit der dichtesten
Atompackung und dem größten Schichtabstand. Die Gleitrichtung ist die Richtung
mit dichtester Atompackung. In dieser Richtung benötigt das Gleiten der
Atomschichten die geringste Energie. Das Kristallgitter hat somit einen Einfluss
auf die Gleitebene und Gleitrichtung.
Verfestigung,
Erholung, Rekristallisation
Mit
steigendem Verformungsgrad nehmen die Zugfestigkeit und die Streckgrenze zu
sowie die Leitfähigkeit und die Fläche ab. Nimmt man einen bestimmten Verformungsgrad
und brennt diesen in einem Ofen so bildet sich über die Brenndauer nach der
Erholung eine Rekristallisation und dann eine Kornvergrößerung aus. Damit nimmt
die Streckgrenze wieder ab, die Leitfähigkeit und die Fläche zu.
Kaltverformung
und Rekristallisation
Rekristallisation
ist der Abbau von Gitterfehlern in Kristallen metallischer Werkstoffe durch
Neubildung des Gefüges auf Grund der Keimbildung und des Kornwachstums. Die
Festigkeit nimmt durch den Abbau von Versetzungen ab. Als
Rekristallisationstemperatur TRmin wird diejenige Temperatur
bezeichnet, bei der ein Werkstoff innerhalb einer Betrachtungszeit vollständig
rekristallisiert. Es gilt TRmin ~ 0,4 TS [K]
Kriechverhalten
Zone
1: Übergangskriechen – Verformung durch Dehnung – Versetzungen im Material
Zone
2: Stationäres Kriechen – Gleichgewicht zwischen Verformung und
Rekristallisation
Zone
3: beschleunigtes Kriechen – Verformung >> als Rekristallisation –
Werkstoff ermüdet und reißt irgendwann
Kapitel 1.7 – Polymerstrukturen
Kunststoffe, Polymere und Plaste
Der
Baustein eines Kunststoffes ist ein Makromolekül, Es entsteht über
Reaktionsmechanismen aus einzelnen Molekühlen, den Monomeren, mit
unterschiedlichen Bauprinzipien.
Die
im Makromolekühl gebunden Atome, überwiegend C und H, sind durch kovalente Bindungen
fest miteinander verbunden. Zwischen den Molekühlen wirken Nebenvalente
Bindungen , Van der Waal Bindungen. Sind die Molekühle durch Hauptvalenze
miteinander verbunden, entsteht ein relativ starres Makromolekühl. Es gibt 3
Kunststoffarten die nach ihren Molekühlbindungen unterschieden werden:
Thermoplaste
sind linear unverzweigte Kettenmolekühle die über Dipolbindung zusammenhalten.
Sie erweichen beim Erwärmen.
Duroplaste
sind räumlich vernetze Gefüge die über Atombindungen Zusammengehalten werden. Sie
sind nicht schmelzbar, quellbar oder löslich und liegen bei Raumtemperatur
zumeist als harte glasartige Stoffe vor.
Elastomere
sind räumlich vernetzte weder schmelzbare noch lösliche aber quellbare Stoffe
die bei Raumtemperatur ein gummielastisches Verhalten aufweisen.
Glasübergangstemperatur
Sind
die Nebenvalenzen bei einer für den Kunststoff typischen Temperatur
„eingefroren“, verhält sich dieser Spröde. Oberhalb der Glasübergangstemperatur
TG wird er formbar.
Festigkeit
In
Abhängigkeit von der Anordnung der Makromolekühle ist ein typisches Verhalten
der Festigkeit als Funktion der Temperatur zu beobachten. Durmomere bleiben
dabei bis zu ihrer Zersetzung hart, Elastomere werden mit steigender Temperatur
weicher, bis sie sich schließlich auch zersetzen. Thermoplaste reagieren extrem
sensibel da sie bei Erwärmung flüssig werden.
Polymerbildung
Polymerisation
nur bei Plastomeren (Termoplaste)
Einzelne
Monomere mit Doppelbindungen werden mittels UV-Bestrahlung behandelt. Dabei
brechen die Doppelbindungen auf und die Monomere reagieren miteinander. Somit
entstehen lange Makromolekülketten.
Polykondesation
bei Plastomere und Duromere
Die
Polykondensation ist eine stufenweise Kondensationsreaktion, bei der viele
Monomere unter Abspaltung einfach gebauter Moleküle (meist Wasser) Polymere gebildet werden. Damit ein Monomer
eine Reaktion eingehen kann muss es mindestens zwei funktionelle Gruppen
besitzen, die besonders reaktionsfreudig sind (-OH, -COOH, CO,…)Durch
wiederholen von diesem Vorgang entstehen lange Makromolekühle.
Polyaddition
bei Plastomeren und Duromeren
Die
Polyaddition ist eine Form von Polymerbildung, die nach de Mechanismus der
nucleophilen Addition von Monomeren zu Polyaddukten abläuft. Dabei werden
verschiedenartige Moleküle mit mindestens zwei funktionellen Gruppen unter
Übertragung von Protonen verknüpft. Bei dieser Art der Verknüpfung muss eine
Sorte von Molekülen Doppelbindungen aufweisen. Im Verlauf ist die Polyaddition
der Polykondensation sehr ähnlich, jedoch ohne das entstehen von niedermolekularen
Nebenprodukten wie Wasser.
Polymerleiter
Da
alle Bindungselektronen fixiert sind, sind Polymere zumeist Isolatoren. Treten
regelmäßige Doppelbindungen auf, so kann ein gerichteter Elektronentransport
erfolgen (z.B. Antistatische Verpackung)
Kapitel 1.8 –
Magnetismus
Kenngrößen
Die
magnetische Feldstärke H erzeugt das Magnetfeld. H = I*n / l
Die
magnetische Flussdichte B gibt die stärke des Magnetfeldes an B0=μ0H
Permeabilität
ist der Verstärkungsfaktor zum Vakuum μ= μ0 μr
mit μ0=4pi10-7
Magnetische
Polarisation J ist die Flussdichte die von einem Stoff verursacht wird
J=
μ0* μr*H- μ0*H
Die
magnetische Suzeptibilität χ= μr-1
Magnetisierung
M=J/ μ0
Magnetismus
Bei
Einwirkung eines äußeren magnetischen Feldes auf einen Werkstoff kommt es zur
Wechselwirkung mit den Bahn- und Spinmomenten. Hat ein Atom in seinem Niveau
zwei Elektronen, die laut Hundsche Regel unterschiedlichen Spin haben müssen,
so heben sich die Spinmomente nach außen hin auf und es bleibt nur das
Bahnmoment übrig. Entsprechend bei Werkstoffen mit nur einem Elektron in eiem
Niveau entsteht nach außen hin zusätzlich ein Spinmoment.
Diamagnetismus
Ein
äußeres Magnetfeld bewirkt ein Eindrehen des Bahnmomentes in Feldrichtung. Es
werden Kreisströme induziert, die dem erzeugten Feld entgegen wirken. Ist dies
die einzige Wechselwirkung (nur das Bahnmomente) so wird das Feld im Werkstoff
geschwächt μr < 1 und χ<0
Paramagentismus
Besitzt
ein Werkstoff unpaarige Elektronen, so kommt es zusätzlich zum Eindrehen der
Bahnmomente noch zur Ausrichtung der Spinmomente in Feldrichtung. Das Feld wird
vom Werkstoff verstärkt μr>1χ>0
Ferromagnetismus
Hierfür
müssen vier Bedingungen erfüllt sein:
1.
Innere
Elektronenschale ist unvollständig besetzt
2.
Unkompensierte
Spins sind vorhanden
3.
Atomabstand ist
mindestens der dreifache Radius der nicht spinkompensierten Schale
4.
Ohne äußere
Einwirkung bildet sich spontane Magnetisierung – Weißsche Bezirke (Domänen).
Sie sind durch Blochwände voneinander getrennt.
µr>>1
χ>>0
Magnetisierung
Solange
kein äußeres Magnetfeld angelegt ist gibt es Weißsche Bezirke mit Blochwänden.
Wird nun ein Feld angelegt. So beginnen sich alle Weißschen Bezirke in
Feldrichtung auszurichten. Sind alle Domänen in Feldrichtung ausgerichtet, ist
die Sättigung erreicht. Eine weitere Erhöhung des Feldes bleibt Ergebnislos.
Wird
ein Werkstoff das erste Mal magnetisiert, so wird das Verhalten über die
Neukurve erklärt. Bei kleinen Feldstärken können sich die Blochwände
Verschieben wodurch sich die Domänen vergrößern. Ist eine Blochwand komplett
aus den Weißchen Bezirken verschwunden, so ist der Werkstoff nach Wegnahme des
äußeren Feldes irreversibel magnetisiert. Somit stellt die normale
Magnetisierungskurve sich als Hysteresekurve dar.
Hartmagnetika
Dies
sind Stoffe die nach abschalten eines äußeren Feldes ihr Magnetfeld aufrecht
erhalten.. Sie weisen eine breite Hysterese auf, was bedeutet, dass viel
Energie für eine Ummagnetisierung aufgebracht werden muss. Hartmagnetika gilt
für Feldeinflüsse H > 30 kA/m. Durch Dotierung kann verhindert werden, dass
sich Weißsche Bezirke ausrichten.
Weichmagnetika
Sie
verhalten sich entsprechend entgegen den Hartmagnetika und verlieren ihre
magnetische Wirkung. Für das äußere Feld sollte gelten H < 1kA/m.
Sättigung
Die
magnetische Sättigung kann nach folgender Formel berechnet werden: JS=µ0MS=µ0µBNAz
mit µB Bohrsches Magneton = 9,27410*10-24 J/T, NA
Avogadro-Konstante 6*1023 Atome/mol und z=Anzahl der Magnetone.
Curie
Temperatur
Abhängig
von der Temperatur lassen sich Werkstoffe leichter magnetisieren. Die
Schwelltemperatur die Curie Temperatur TC, gibt an, ab welcher
Temperatur ein ferromagnetischer Werkstoff paramagnetisch wird.
Χ=
χ(T)=C/(T-TC) mit C=Konstante
Kapitel 1.9 –
Supraleitung
Elektrischer Widerstand bei tiefen Temperaturen
- Supraleitung
besteht darin, dass der elektrische Gleichstromwiderstand bei
Unterschreitung einer Sprungtemperatur der Curie Temperatur TC,
diskontinuierlich auf Null fällt, Dies nennt man Supraleitung der ersten Art.
- Im supraleitenden
Zustand wird as Magnetfeld aus dem stromdurchflossenen Leiter verdrängt.
Der supraleitenden Zustand kann durch eine äußeres Feld aufgehoben werden.
Dies geschieht ab der kritischen Feldstärke HC und der Effekt
heißt Meissner-Ochsenfeld-Effekt. Harte Supraleiter, Supraleitung der
zweiten Art, weist zwei kritische Feldstärken auf. Bei der unteren beginnt
der Leiter vom Feld durchflossen zu werden. Es liegt jedoch noch Supraleitung
vor. Bei der oberen kritischen Feldstärke bricht dann die Supraleitung ab.
- Die kritische
Stromdichte jC begrenzt die Supraleitung ebenso wie die oben
genannten Punkte.
Elektronenpaare (Cooper-Paare)
Bei
Unterschreitung von TC treten zwei Elektronen mit entgegengesetztem
Spin und Impuls zu einem Elektronenpaar zusammen. Dieses Paar bewegt sich
schließlich bei einwirken eines Impulses einheitlich in Feldrichtung. Während
der Werkstoff supraleitend ist werden diese Elektronen nicht gestreut. Die Kohärenzlänge
von Cooperpaaren (der Abstand ) beträgt 100nm bis 1000nm
Meissner-Ochsenfeld-Effekt – kritische Feldstärke
Während
der Supraleitung verdrängt der Werkstoff das äußere magnetische Feld komplett.
Über einem starken Magnetfeld wird der Werkstoff im supraleitenden Zustand
schweben. Es gilt HC/H0=1-(T/TC)2.
Kapitel 1.10 –
Dielektrische Polarisation
Kenngrößen
Plattenkondensator: E=U/d und Q=ε0*A*E mit ε0 = 8,85*10-12
Verschiebungsdichte
D = ε0*E
In
Materie D= ε0*E+P =
εR ε 0*E
Polarisation
P=( εr-1) ε0*E=χ ε0E
Elektrische
Suszeptibilität: χ = εr-1
Kondensator
Die
durch die Coloumbschen Kräfte im Dielektrikum erzeugte Ladungsverschiebung ist
dem Potential U der erregenden Feldstärke E entgegenwirkt. Durch die in einem
paraelektrischen Werkstoff orientierten Dipolmomente werden Ladungsträger
kompensiert und es können weitere Ladungsträger aus der Spannungsquelle auf die
Metallplatten fließen. Die Ladung Q des
Kondensators wird damit größer: Q=CSU. Bei konstanter Spannung
steigt die Kapazität des Kondensators mit zunehmendem εr Somit gilt CS =
εr*C0 . Da auch die Kapazität direkt proportional
zur Fläche A der Kondensatorplatten und umgekehrt proportional zum Abstand ist
folgt: CS= ε0 εr*A/d
Polarisation
Verschiebungspolarisation
Sie
tritt als Elektronen und Ionenpolarisation auf. Elektronenpolarisation entsteht
durch Verschiebung der negativen Elektronenhülle gegenüber dem positiven Kern.
Dieser Effekt tritt bei jedem Werkstoff auf und ist reversibel. Bei einem
Wechselfeld bis 1014 Hz können die Elektronen ohne
Phasenverschiebung diesem folgen.
Ionenpolarisation
Sie
tritt bei Isolatoren mit Ionengitter auf. Hierbei wird das Kationenuntergitter
gegen das Anionenuntergitter verschoben. Dieser Effekt ist reversibel. Dabei
können die Ionen einem Wechselfeld bis 1011 Hz folgen. Dies liegt an
der deutlich höheren Masse von Ionen im Gegensatz zu Elektronen
Orientierungspolarisation
Bei
permanenter Anwesenheit von Dipolen im Dielektrikum kommt es zur
Orientierungspolarisation in Feldrichtung. Sie kann bis zu einer Frequenz von
ca. 1011 Hz einem Wechselfeld folgen.
Frequenzabhängigkeit von εr
Die
Permitivität ε r =√n = εr.Dipol + εr,
Ion + εr,Elektron ist frequenzabhängig. Ab Frequenzen
oberhalb von 1011 Hz hat εr,Dipol keinen Einfluss mehr und ab 1014 Hz
wirkt nur noch εr,Elektron.
Dielektrischer Verlustfaktor
Wirkt
auf einen Kondensator mit Dielektrikum eine Wechselspannung, dann ändert sich
in diesem die Verschiebungs- oder Drehrichtung der Ladungsschwerpunkte. I takt
der Frequenz ändern sich im Werkstoff die Polarisationsrichtungen und die
Dipole beginnen zu schwingen. Diese Schwingung erzeugt Wärme, welche den
Verlust darstellt. Die Änderung der Polarisationsrichtung erfordert Arbeit, die
bei der Kondensatorspannung U durch den Wirkstrom I geleistet wird. Somit gilt
tan δ = IV/IC oder bei einer Parallelschaltung von
Kondensator und Widerstand tan δ = IR/IC und es
gilt: NV=U2*2π*f* ε0* εR*tan
δ. Somit kommt bei einem leitenden Dielektrikum ein imaginärer Summand
hinzu εr = ε1 + jε2 und es gilt
weiter tan δ = ε2/ε1.
Einteilung der Dielektrika
Alle
ferroelektrischen und nicht ferroelektrischen Werkstoffe sind pyroelektrisch.
Alle pyro- und nicht pyroelektrische sind piesoelektrisch und diese komplemente
zählen zu den dielektrischen.
Ferroelektrische Hysterese
Ein
besonderer Fall bei der Orientierungspolarisation ist die spontane Polarisation
die das ferroelektrische Verhalten Verursacht. Entgegen der Wärmeschwingung der
Dipole, die ihre völlig gleichsinnige Orientierung verhindern, kommt es in
Ferroelektrika, unter bestimmten strukturellen Bedingung zu Gleichgesinnung der
Dipole. Diese Gebiete nennt man Domänen. Sie entsprechen den Weißschen Bezirken
in ferromagnetischen Werkstoffen. Durch
anlegen eines äußeren Feldes kommt es zur gleichsinnigen Orientierung der
Domänen bis hin zur Sättigung.
Piezoelektrischer Effekt
Wird
ein Piezoelektrisches Material mechanisch belastet, so führt dies zu einer
Verformung der Gitterstruktur und zu einer Polarisation. Sogleich werden dann
die Außenflächen geladen. Dieser Effekt heißt Piezoelektrisch.
F*Δx=Q*U
= δ*A* Δx mit D=Q/A und d= Δx/U folgt D= δ*d.
Nichtferroelektrische Phasenübergänge
Bei
hohen Temperaturen wird das Material paraelektrisch. Bei Abkühlung findet ab
einer Schwelltemperatur kleiner der der Aufheizung ein Phasenübergang mit
Struktur Veränderung statt und das
material wird wieder ferrorelektrisch. Die Polarisationsrichtung kann durch
eine äußeres Feld verändert werden.
2.x – Hall Effekt – Hall Generator
Der Hall-Effekt tritt in einem stromdurchflossenen elektrischen
Leiter auf, der sich in einem Magnetfeld befindet, wobei sich ein elektrisches
Feld aufbaut, das zur Stromrichtung und zum Magnetfeld senkrecht steht und das
die auf die Elektronen wirkende Lorentzkraft kompensiert.